心房細動は、ERでも病棟でも遭遇しない日はないと言えるほど頻度の高い疾患です。
高齢者や重症患者ではその有病率が有意に多くなり、もはやcommon diseaseとなりました。
しかし、対応に苦慮することが多いのも心房細動だと思います。
頻脈でバイタルサインが悪いんだけど…
rate controlとかrhythm controlとかっていうけど適応に迷う
抗凝固療法ってどうするんだっけ?
今回は「ERにおける心房細動への対応」をまとめました!
これで心房細動で困ることはだいぶ減るかも⁉
以下を参考にまとめました。
➀Milman B, Burns BD. Atrial fibrillation: an approach to diagnosis and management in the emergency department.
Emerg Med Pract. 2021 May;23(5):1-28.
PMID: 33885254.
②Emergency Medicine Reports Aplil 1,2018
③日本循環器学会 / 日本不整脈心電学会合同ガイドライン
不整脈薬物治療ガイドライン(2020年度版)
疫学
心房細動は年齢が上がるにつれて有病率が上昇する疾患です。
以下の図を参照してもらうとわかるように、80歳以上では9%程度(男女比率が異なります)の有病率となります。

(
JAMA. 2001 May 9;285(18):2370-5.)
米国では、現在約310万人が心房細動と診断されており、2050年までに米国では約700万人の成人がAFに罹患すると推定されています。これは65歳以上の人口が2018年:5200万人→2050年8850万人に増加することに起因するそうです。
超common diseaseであることがわかります。そしてこれから増えていくそうです。
さらに、医療費の問題もバカにはできません。。
2011年時点までで少なくとも毎年66.5億ドルの損害が発生しており、最大200億ドルとも推定されています。これから高齢化がさらに進んでいくととんでもない額の損失になりそうです。
心房細動と言えば、
血栓塞栓イベントが気になります。
以下のような恐ろしいデータがあります。
・
AFに関連した虚血性脳卒中のうち20%は、脳卒中自体がAFの最初の臨床症状・
抗凝固薬治療未治療の場合には5%/年で脳梗塞を発症する ◦CVA/
TIAの既往がある場合には10%/年にまで上がる
◦CT/
MRIで特定される無症候性
脳梗塞は20-40%にものぼる
→抗凝固薬により、
脳梗塞発症リスクを最大2/3にまで減少させられる
・
親世代にAFの病歴が若年成人では、
脳卒中の独立したリスクが上昇する(5.2% vs 2.7%)
心房細動があると、55歳以降の死亡率が2倍になるというデータも出ています。
適切に対応してあげないと予後にも直結するようです。
AFのリスク因子は以下とされています。
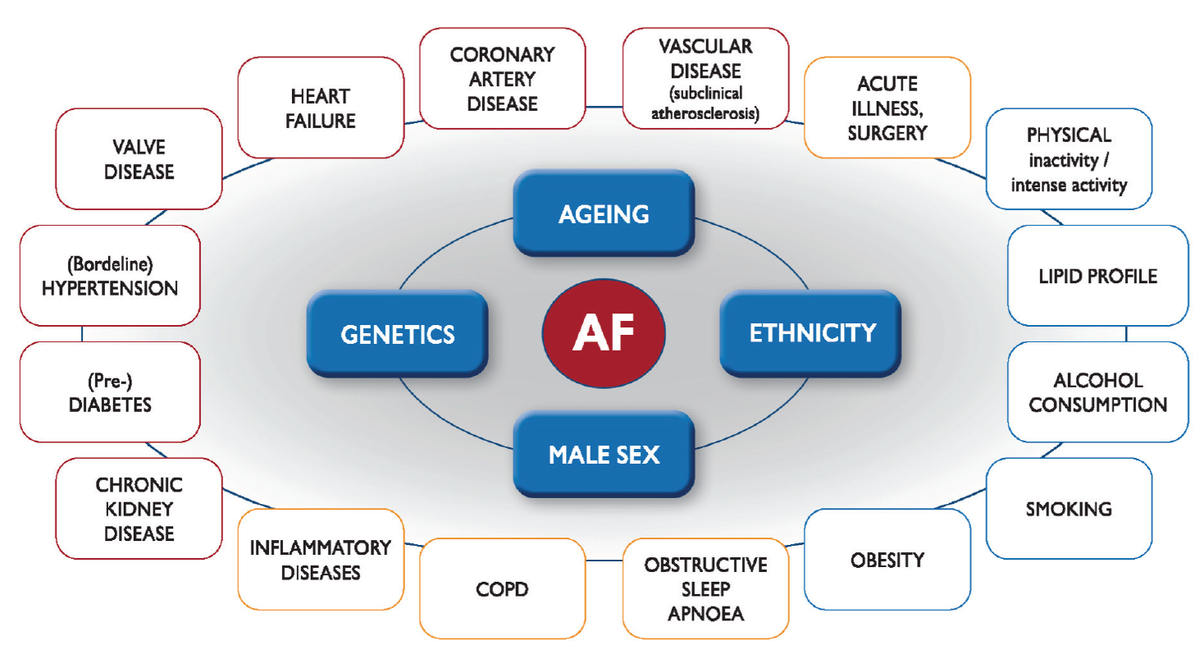
(
Emerg Med Pract. 2021 May;23(5):1-28.)
ほとんど全部、、、なんでもやんけ。
構造的な心疾患がなくとも発症する可能性がありますが、多くの併存疾患が心筋の構造的変化を引き起こすことを示す証拠が増えてきていて、結局多くの疾患が心房細動を引き起こすきっかけになってしまうんですね。
遺伝的要因もあり、第一度親近者にAFの家族歴があると最大で40%のリスク上昇があると報告されています。家族もか。
病態生理/分類
・AFは心房の高周波性興奮により、非同期な心房収縮と不規則な
心室応答が生じる
"irregularly irregular"なリズムを特徴とする
・AFの基礎となる病態生理は、多くの場合においてリエントリー回路である
・AFは肺静脈の外側を走行する心房からの異所性興奮によっても引き起こされて維持されることがある
・異所性興奮やリエントリー回路の位置は肺静脈/右心房/左心房のいずれかとされる
心房細動の分類は以下のようになっています。
|
・発作性心房細動(Paroxysmal AF):7日以内に停止するAF
・持続性心房細動(Persistent AF):7日以上持続するAF
・長期持続性心房細動(long-standing persistent AF):数か月~1年持続するAF
・ 永続的AF(Permanent AF):薬物学的/電気的に除細動 不能な心房細動 |
一般的には、発作性心房細動から始まります。
これは、特に治療介入しなくとも48時間以内には洞調律に復帰していきます。
(以下に紹介するwait-and-see approachはこの事実から派生したものです)
その後、心房細動と洞調律を繰り返し、次第に永続する慢性心房細動になっていきます。発作性心房細動は5.0-8.6%/年の割合で慢性化するとされ、5年間で約25%が慢性心房細動に移行することが知られています。
診断
病歴/身体所見
ERを受診する場合には、
・疾患そのもので受診する場合
・他の代謝性疾患やストレス要因(敗血症/内分泌障害/薬物アルコール乱用/肺血栓塞栓症/心不全など)が原因で受診する場合
の2種類の受診の仕方があります。
心房細動になってしまった原因についてはいつも考えておかなければなりません。
以下で詳述はしていきますが、マネジメントの際にも重要な考え方で、ただrate/rhythm controlを考えるだけでは改善せず、逆に悪化してしまうようなこともあります。
原因については"PIRATES"で覚えておくとよいでしょう!
|
P – Pulmonary embolism
I – Ischemic heart disease, Inflammation (心筋炎), Idiopathic/iatrogenic
R – Rheumatic heart disease (弁膜症…MR/MS)
A – Alcohol (holiday heart syndrome), Anemia, Atrial enlargement/myxoma, Age
T – Thyroid disorder ( 甲状腺クリーゼ)/Toxins(違法薬物/カフェイン/タバコ/アルコールなど) E – Electrolyte abnormalities, electrocution, exacerbation (of CHF)
S – Sepsis, Stimulants, Sleep apnea |
特に救急外来においては
肺塞栓/心筋梗塞/貧血/脱水/甲状腺クリーゼ/電解質異常/敗血症あたりは絶対にマークしておきます。
胸痛/呼吸困難/めまい/動悸/
疲労感などを訴えます。
可能であれば以下の病歴を聴取します。
・発症のタイミング…特に明確な発症時間から48時間(できれば12時間)以内かどうか
・過去の同様のエピソード…失神/動悸など含めて
・家族歴…心疾患や内分泌疾患も含め
・社会歴…薬物やアルコールの使用状況など
‣飲酒による心房細動誘発もある(holiday heart syndrome)
・AF評価において役立つ身体所見は以下
◦DVT/PE…片側四肢の疼痛や浮腫/
ホルモン剤使用/喫煙/最近の手術歴
◦弁膜症…聴診
当然ですが全てのバイタルサインを把握しておくことが重要です。
心房細動の際に問題になるのが「血圧」の項目ではないでしょうか?
モニターでは完全に低血圧だけど橈骨動脈はしっかり触れるんだよな~なんてときには3回くらい測定してみましょう。
心房細動の際には脈拍の変動に伴い血圧も変動することが知られています。
だいたい3回も測定すれば、洞調律でも心房細動でも血圧の正確性に差はないとされています。何度測定しても低血圧なら真に低血圧と判断してよいです。
この人、心房細動だから血圧低いんだよ~。なーんて言ってたら本当に血圧が低くて、これで大動脈解離だったことがあったなぁ。ちゃんと橈骨動脈を触知することが最も大事なことです。
心電図検査
心房細動とは、
心電図で識別可能なP波がなく、不規則な心室リズムを認めることが定義となります。
・ほかに、心房が細動しているために等電位線がないことも特徴
・心拍数≧100の場合には速い
心室応答があると考えられる(
rapid ventricular response:RVR)
◦基礎疾患や心拍数に影響を与える薬剤投与がなければ110-160bpmほどになることが多い
ところで心電図の自動解析は使用していますか?
HRとかQT時間とか計算されたものに関してはそれなりに有用と思います。しかし、診断についてはかなりイマイチだと思いますので注意が必要です。
「AFと心電図自動解析されたものの9%が誤診である」という報告があり、特にPACやアーチファクトがある洞調律とAFが誤診されることが多いとされるため、自分の目で見てしっかり確認することは重要です(そもそも自分の目も怪しい⁉)
鑑別となる心電図を貼っておきます。
・AFとAFL

・洞調律

・MAT…特に
COPD急性増悪で低酸素血症を伴うときによく見られます
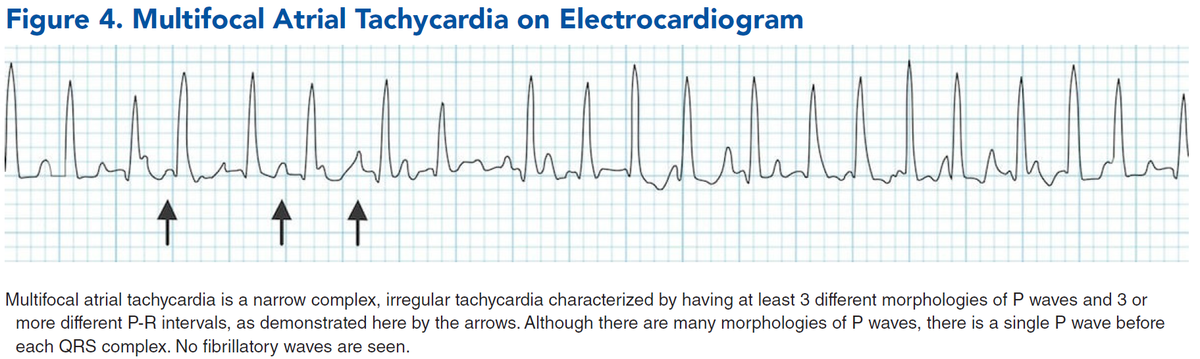
・AF

・AF with RVR

・AF with WPW syndrome

・AFL
ここで、注意するポイントが2つあります。
注意点➀
上で紹介していますが、
WPW症候群にAFが合併するとものすごい頻脈になります。
特にwide QRS irregular tachycardiaになると思います。このときに房室伝導を遅延させる薬剤(rate controlに使用する薬剤)を使用すると大変なことになります。詳述はしませんが、正常な房室伝導より副伝導路を優先的に使うようになるため悪化します。
注意点②
・胸痛+STE/STD>2mmがあればAMI合併を疑え
AMIを合併していないか解釈することは結構難しいですよね!?
109人のAF+
ACSを示唆する症状を持つ患者に対するprospective cohort studyでは以下のような結果が得られています。
・6人(5.5%)がAMI
・AMIだった患者は胸痛/新規発症AF/STE/STD>2mmがみられた
・胸痛+STD>2mm or STEはAMI診断において感度100%/特異度99%
血液検査
・考慮すべき検査項目は以下
|
・血算
・血液ガス
・トロポニン
・凝固機能検査
・(妊娠可能な年齢の女性)妊娠検査
|
血清Mg低下は心房細動の発症と関連があると考えられています。
Framingham Heart Studyの二次解析にて、心房細動の既往がない患者を血清Mg値に応じて4群に分類したところ、最低値群は他の群に比較してAF発症率が50%増加したと報告されています。
ただし、血清Mg値は生理的活性があるMgとの相関性が低いため、
この検査を行うことにより偽陽性や偽陰性が多くなる可能性があるため、ルーチンでの検査は不要です。
新規発症の心房細動や、既知の甲状腺疾患のある心房細動患者(特に3か月以内にTSH測定されていない)で検査すべしです。
・2000人のAF患者のうち2%しか
甲状腺機能異常がなかった
・そのほとんどが上記患者であった
・新規に
甲状腺機能亢進症と診断された患者はそれ以外に比較して心房細動発症率が2倍高くなる
とくに、
発熱+意識障害+AF with RVRでは
甲状腺クリーゼ診断の重要な手掛かりとなります。
トロポニン
心房細動患者における有意な冠動脈疾患の有病率は22-49%であり、
ACSに起因する心房細動の発症率は5-23%とされています。
AFを発症している人は冠動脈疾患の有病率が高いし、ACSによるAFの発症もありえますので注意が必要です。
2018年のMAによれば、心房細動患者においてcTn上昇は全死亡および主要有害心イベントリスク上昇の独立因子であることがわかっています。
また、ER初診の心房細動患者のcTnI上昇は
死亡率予測因子となっており、
予後不良のマーカーになります。
ということで、cTnは40歳以上の患者や冠動脈疾患リスクが高い患者には必ず測定して解釈する必要がありますが、AF with RVRによりcTnは上昇することには注意を要します。
D-dimer
肺塞栓の危険因子や既往歴を持たない患者では、心房細動の存在だけではD-dimer検査を行う必要はありません。
肺塞栓症が臨床的に疑われてERを受診した患者2272人における
肺塞栓症の有病率は、心房細動既往がない患者では23%、既往がある患者では19%であったとの報告から、心房細動の存在単独では肺塞栓のリスクにはならないようです。
画像検査
心房細動で受診した全ての患者に胸部単純レントゲン検査を行うことが推奨されます。
・植え込み型除細動器やペースメーカーなどの有無
POCUSも使用可能です。特に、心嚢液貯留など低血圧患者におけるほかのショック原因検索では効果を発揮します(RUSH)。駆出率の推定や治療方針の指診にもなりえます。
ERでの評価を終え帰宅させる場合には、内科外来での超音波検査を依頼しておきます。
なお、
経食道心エコーは48時間以上の症状があり、3週間以上抗凝固療法を受けておらず、除細動が計画されている場合に考慮されます。抗凝固療法が適切に行われている場合には、
血栓塞栓症リスクは1%未満なのでER患者への心臓超音波検査を予定する必要はありません。
マネジメント
ERにおけるAFマネジメントの目標(全ての患者で考えること)
心房細動でERを受診した患者のマネジメントの目標は大きく3つあります。
➀AFを発症した原因検索と血行動態の安定化
③合併症予防
➀AFを発症した原因検索と血行動態の安定化
全ての患者で広く鑑別を挙げて考えるべきです。
上述しましたが、"PIRATES"で考えます。
|
P – Pulmonary embolism
I – Ischemic heart disease, Inflammation (心筋炎), Idiopathic/iatrogenic
R – Rheumatic heart disease (弁膜症…MR/MS)
A – Alcohol (holiday heart syndrome), Anemia, Atrial enlargement/myxoma, Age
T – Thyroid disorder ( 甲状腺クリーゼ)/Toxins(違法薬物/カフェイン/タバコ/アルコールなど) E – Electrolyte abnormalities, electrocution, exacerbation (of CHF)
S – Sepsis, Stimulants, Sleep apnea |
特に救急外来においては
肺塞栓/心筋梗塞/貧血/脱水/甲状腺クリーゼ/電解質異常/敗血症あたりは絶対にマークしておくんでした。
"PIRATES"とも関連しますがどうやって血行動態を安定させていくかは原因次第です。
β-アドレナリン作動性昇圧薬が使用されていれば中止か最小限にしたり、場合によっては輸液負荷が有効なこともあります。
心房細動のマネジメントでは原因疾患を叩くことが非常に重要です。
ときに心房細動だけを治療しようと頑張ってしまいますが、それはうまくいかないことがあります。
・AF/AFLの患者1112人を対象としたretrospective study
・416人(37.4%)が急性発症の基礎疾患を有していた
…3割以上が急性疾患ありきの心房細動
・これらの患者に対してrate/rhythm controlを行うことで無介入群と比較して合併症が増加(40.7% vs 7.1%, RR5.7)
・rate control達成率はなんと無介入群(輸液など)の方が良好(19.0% vs 44.5%, RR2.3)
・cardioversionの有効性も13.3%にとどまった
背景疾患の治療を優先させることが重要であることがわかると思います。
rate controlや適応があればrhythm controlなどを行います。
意外とここが難しいところです。
③合併症予防
心房細動は脳塞栓症リスクです。なのでリスク層別化を行い、リスクがあればERで抗凝固薬を処方するまでがお仕事です。
血行動態が不安定な場合
血行動態不安定とは "いしき心配" に当てはまる場合のことを指します。
|
い:息切れ
し:ショックの徴候
き:胸痛
配:肺うっ血
|
血行動態が不安定と判断した場合には、同期下でcardioversion!が最優先です。
ただし、PAF/新規発症AF(New-onset AF:NOAF)の場合です。永続的心房細動になってしまっている場合には効果がないのでrate controlに逃げることになります。
鎮痛や鎮静をしたほうが良いですが、そのためにcardioversionが遅れてはなりません。
※NOAF…慢性または発作性心房細動を患っていなかった患者において、
重篤な疾患を背景に新規に出現した心房細動を指します。一般的な例として
敗血症性ショックの患者が挙げられますが、
NOAF発症率は10%程度とされています。
さて、どのくらいのエネルギー量が推奨されているかというと、、、
・ACLS guideline推奨…120-200J
・Canadian Cardiology Society(CCS) guideline推奨…150-200J
だいたい100-200Jの範囲でcardioversionを試みるのが良いと思います。
ただし、肥満は別格です。肥満では200J推しです。
380人のPAF患者(平均BMI28)に対して、escalating energy protocol(100-150-200J) vs non-escalating protocol(200-200-200J)でのcardioversio成功率を比較した試験(The BEST AF Trial)では、、、
・初回cardioversion成功率…48% vs 71%(p<0.01), NNT4
・初回cardioversion成功率(BMI>25)…44% vs 75%(p=0.01), NNT3
・初回cardioversion成功率(
BMI≦25)…59% vs 50%(有意差なし)
これをまとめると、標準体重では100Jからでもよさそうだが、肥満の場合には200Jから開始したほうがよいということになりそうです。
上記cardioversionだけでどうしてもうまくいかないこともあります。
そのようなときに試みる方法として以下が提案されています。
➀パッド装着部位を前と後ろ(AP)にしてみる
AP>ALでcardioversion成功率が高いという報告もされており、特に肥満患者なんかでは前と後ろにパッドを装着するのがよいでしょう。
意外とALで貼っているときには心臓を挟めていないことがあります。
ただし、基本的にはAL推奨であることは間違いなさそうです。
(Circulation . 2021 Dec 21;144(25):1995-2003.)EPIC trial
APを選択するのは困ったときの次の一手という感じでしょうか。
②薬剤を併用してみる
可能であればamiodarone±magnesiumをcardioversion前または後に投与することで洞調律を達成および維持する可能性を高められると報告されています。この2剤だから投与可能だけど、間違ってもワソランなんか入れた日には…血行動態がさらに破綻する恐れがあります(以下で詳述します)
副伝導路を伴うAFの場合
通常のAFの場合には、心拍数は房室結節の不応期によりある程度制限されています。概ねHR120-180bpm程度であり、臨床的にもよく遭遇するのではないでしょうか。
ただし、
副伝導路(WPW症候群とか)があると、房室結節と副伝導路からの両方の刺激が心室に到達でき、かつ副伝導路の方が房室結節よりも不応期が短いことが多いため高度な頻拍になることがあります。
以下の場合には、
あれ!?WPW症候群+AF(pseudo VT)かも⁉と疑います。
・HR>200bpmほど(特にHR>220bpm)
・irregularly irregular(コレは普通にAFの特徴ですが)
・QRS波形が一拍ごとに異なるなど
上記の場合には、副伝導路を伴うAFの可能性があり、房室結節の伝導を低下させる薬剤は禁忌になることを覚えておきます。房室結節伝導速度を落とすことで副伝導路の優位性が高まりより高度な頻脈になることがあります。
・ABCD禁忌!で覚えておく
◦amiodarone, ATP
◦β-blocker
◦Ca拮抗薬
◦digoxin
この場合、治療可能な薬剤はprocainamideまたはibutilideに限られますが、おとなしくcardioversionしておくほうがよいと思います。
血行動態不安定+発症時間不明 or 発症から48時間以上経過
この場合には、まずはヘパリン静注をcardioversionに先行させてからcardioversion、またはcardioversion直後に抗凝固療法を開始することになります。
どのくらいのヘパリン静注をすればよいのかはあまり
エビデンスがない分野ではありますが、
2000-5000単位または80単位/kgを静注します。
待てるのであれば
脳梗塞リスクを下げるために4週間以上の抗凝固療法が必要になりますが、血行動態不安定の場合にはリスクを覚悟してやらなければならないときもあると思います。
発症から何時間までcardioversionは安全か?
巷では、「48時間以内」がキーワードになっていますがこれってどのくらい安全なんでしょうか。
Canadian Cardiovascular Society(2018年)やAHA/ACC/HRS(2019年)の
ガイドラインでは
「48時間」という時間制限に注意を促しています。
抗凝固薬なしの状況におけるcardioversionでは、、、
・発症から48時間以内であれば
血栓塞栓イベント発症率0.7%
・12時間未満…0.3%、12-24時間…1.1%
発症から12時間を経過するとcardioversionによる血栓塞栓イベント発症率が急上昇します。
なので、可能であれば12時間以内のcardioversionが好ましいと考えられます。
血行動態が安定している場合
rate control vs rhythm controlは救急分野において昔から議論になっている関心事です。
landmark studyとしてAFFIRM trialとRACE trialがあります。
・AFFIRM…rhythm controlには生存率の点から利点がなく、rate controlの方が優れている可能性が示唆
・RACE…合併症の死亡率の観点からrate controlがrhythm controlと比較して非劣性であることが示された
これらの研究の結果に疑問が投げかけられ、いろいろな結果の巻き返しがありました。
しかし、それらの研究はすべてERでのマネジメントを想定する短期的アウトカムではなく、長期的なアウトカムに焦点が当てられていました。最近(N Engl J Med. 2021 Jan 28;384(4):353-361.)では、無作為化試験により心房細動の診断後早期に洞調律が維持された患者や左室機能が低下してアブレーション治療を受けた患者では死亡リスクが低下することが示唆されましたが、これも長期的予後の話です。
ERにおける短期的な観点からみた場合にはどうなんでしょうか?
2019年の
HERMES-AF studyによれば、rhythm control群では症状緩和率が高く入院数も減少したことが報告されました。
・発症から48時間未満かつ年齢65歳未満ではrhythm control
・
心不全/弁膜症/高血圧/permanent AFではrate contorolが好ましい
・(条件を満たせば)rhythm controlはrate controlと同様に安全であり、ERからの退室までの時間/入院期間が短縮し、入院率の低下に関連するため好まれるかもしれない
別のランダム化多施設試験(4060人:平均年齢70±9歳が対象)では、
・rate control群の方が入院率が低い
・rhythm control群で副作用が多い
・死亡率は有意差なし
なんとなく高齢者にはrate control、若年ではrhythm controlと分けられそうです。
原則的な適応は以下の通りです。
|
rate controlに適する
|
rhythm controlに適する
|
|
・年齢>65歳
・基礎疾患を多数持つ
・発症から48時間以上経過
・persistent AF
・リウマチ性心疾患
・機械弁
|
・年齢≺65歳
・基礎疾患が少ない
・発症から48時間以内
・paroxysmal AF
・3週間以上抗凝固治療がされている
・rate controlへの反応不良
|
これも絶対的なものではなくて、地域による差異があるみたいです。
1917人の救急医を対象とした国際的な調査では
・米国救急医の94%がrate contorlを常に/ほとんどの場合に選択する
・カナダの救急医は66%が常に/ほとんどの場合にrhythm controlを選択すると回答した
日本ではどうでしょう。地域によると思いますが、結構rate control寄りではないでしょうか。個人的には、人手のある日中なら適応があればrhythm control、夜間はrate controlで逃げるなんてことが多いかも。
第3の選択肢として
wait-and-see approachなんてのもあります。
delayed cardioversion approachとも呼ばれているそうな。
これは多くの患者がER退室後24時間以内に心房細動が自然停止するという考えから派生した対応方法です。
wait-and-see approachが早期除細動に比較して非劣性か検証した、2019年に発表された多施設共同無作為化非劣性試験を紹介します。
・発症から36時間未満のAFを有する血行動態が安定した成人437人
・wait-and-see群ではrate controlが行われ、翌日に外来受診して診察を受けた
‣
脳卒中リスクが高い患者には除細動前または直後に経口抗凝固療法を開始した
・4週間後の診察では洞調律維持率はwait-and-see群91% vs 早期除細動群94%
・いずれの群でも
脳卒中1例/
血栓塞栓症3例が発生した
ノースカロライナ大学も同様の
プロトコルを実施し、
AFでERを退室した患者の63%が2-3日以内に洞調律に自然復帰することが明らかになりました。
PAFであればwait-and-see approachも施設の実情などに応じて考慮できそうですね。
注意点として、
まだwait-and-seeを推奨するにはさらなるエビデンスの蓄積を要すること/翌日に循環器内科(または実情に合わせてERなど)でのフォローが可能であること/血行動態が安定している患者に対してリスクに応じた抗凝固療法を行ってからERから帰宅させることは忘れてはなりません。
繰り返しになりますが、24時間以内に再評価可能であることが担保され、適切な抗凝固療法を受けている血行動態の安定した患者に考慮します。
rate control
■心拍数の目標
rate controlの目標は、心拍数≺100-110bpm程度でよいと考えられます。
tight(≺80)vs looser(≺110) controlで予後に有意差はないそうです。
ただし、重症患者における理想的な心拍数はわかっていない分野です。
むしろ軽度の代償性頻脈状態にしておいた方がよいこともあります。
以下、expert opinionレベルの話ですが、、、
・HR>150では拡張期充満がされずに1回拍出量が低下する
→rate controlを考慮するとよい
・HR<150の場合、拡張期充満は問題ないことが多い
→心拍数を低下させすぎることで心拍出量が低下することがある
・多くの重症患者ではHR130程度でよいのかもしれない
特に重症患者では心拍数だけでは循環を語れませんので、他のパラメータから総合的な判断が必要ですので画一的な対応は厳しいです。
■rate controlにおける薬剤の選択
房室結節の不応期を延長する薬剤を用いたコン
トロール方法です。
血行動態が安定しているAF with RVRマネジメントの最初のステップとして結構気軽に試されることが多いです。
血行動態が安定している心房細動患者の急性期のrate controlにはβ遮断薬または非ジヒドロピリジン系Ca拮抗薬を検討することになります。
β遮断薬とCa拮抗薬における死亡率/rate control成功率/有害事象/ER滞在時間/入院必要率/その他の
転帰の違いについて研究はされていますが、文献や
ガイドライン間でのコンセンサスはありません。施設で使い慣れたものを使えばいいと思います。当院ではverapamil(ワソラン)が多く使われます。
どの薬剤を選択するかは患者の血行動態によるところが大きいです。
間違っても血行動態不安定("いしき心配!")に対してβ遮断薬やCa拮抗薬を使用しないことは絶対に守ってほしいところです。「
心不全の御加療お願いします。AF頻脈に対してワソラン静注しました」という他院からの紹介で救急搬送中にショックに陥った患者を何度見たことか…、とほほ。
個人的な使い方を列記しておきます。
・血行動態安定ならβ遮断薬やCa拮抗薬
※HFrEFがある場合には禁忌!
・不安定性が強いときにはdigoxinを選択
・血行動態不安定で、特に除細動を考慮している場合にはamiodarone
・血行動態不安定で、除細動を考慮していない場合にはlandiolol少量から
・Mgは上記治療に組み合わせてみてもいいかも
|
薬剤
|
投与方法
|
禁忌
|
|
metoprolol
|
5分かけて2.5-5mg IV 5分毎 max15mg
|
|
|
landiolol
|
(心機能低下時)
1mcg/kg/minから開始し、10分毎に1-2mcg/kg/minずつ増量
max 10mcg/kg/min
|
喘息に注意
|
|
diltiazem
|
・5分かけて0.25mg/kg(max 20mg) IV
→5-15mg/hrで持続投与
・初回投与に反応が乏しければ、15分後に0.35mg/kg(max 25mg)IVも可能
|
|
|
verapamil
|
5分かけて5-10mg IV
|
|
|
digoxin
|
5分かけて0.25-0.5mg IV 6時間毎(24時間で最大1.5mgまで)
|
腎不全
|
|
amiodarone
|
125mg+5%ブドウ糖液100ml 600ml/hrで投与
→750mg+5%ブドウ糖液500mlを33ml/hrで6時間
→17ml/hrで18時間
|
|
|
magnesium
|
30分かけてMgS 2.5-4.5g+生食100ml IV
※硫酸Mg20mEq/20mlには2.46gのMgSが含まれる
|
腎不全では注意
|
●β遮断薬
左室機能不全や
甲状腺機能亢進症がある場合は第一選択薬になりえますが、
急性心不全患者への使用は慎重にならなければいけません。
ERでのrate control対応で良く使用されるのはmetoprololであり、Ca拮抗薬にある
陰性変力作用がないため
心不全でも使えるとされることはありますが、何度も言う通りできる限り避けるべきと思います。
低心機能例(LVEF<40%)においては、
landiololが使用可能です。日本の
ガイドラインによれば、
少量(1mcg/kg/min)から徐々に漸増する(max 10mcg/kg/min)方法での投与が推奨されています。
ERではあまり使わないかもしれませんが、β遮断薬の貼付薬(ビソノテープ)なんかは選択肢にいれておいてもいいと思います。
unstableではなく、明らかなhypovolemiaや
電解質異常などの原因がない場合には、使ってみてもよいでしょう。
安全性も高く、夜間に病棟で呼ばれてう~んどうしようというときにはこれを貼って経過観察するのも許容される対応だと思います。
(ただし、血行動態が負の方向に変化しないか注意して経過観察は必須)
●Ca拮抗薬
diltiazemとverapamilが該当します。
海外ではdiltiazemはAFのrate controlに多く使用されていますが、日本ではverapamilだろうと思います。
diltiazemは体重に応じた投与量が設定されており、以下のような投与が推奨されています。
・0.25mg(max20mg) IV
→効果不十分であれば0.35mg(max25mg) IV投与
投与速度も一応考えておきましょう。
ベラパミルは1 mg/分、ジルチアゼムは2.5 mg/分の速度で投与することで低血圧の発生率を最小限にすることができます。
なので、それぞれ生食50-100mlに溶いて5mg/10mgを10分かけて点滴静注くらいにしておいた方が失敗が少ないです。
β-blocker vs Ca拮抗薬論争はありますが現時点ではevidenceに乏しいと考えます。
・
心不全のないAFに対するdiltiazem vs metoprolol
◦1時間以内にHR<100bpm達成率はdiltiazemで40%高い
◦30分以内でも約50%成功率が高い
⇒現時点では、rate controlに関してはdiltiazemに軍配があがるかも
◦しかし、65歳以上ではERでのCa拮抗薬使用が90日死亡率上昇と関連していた
ただし、HFrEFが基礎にある場合にはジルチアゼムを使用してはいけません!
心機能評価に自信が持てない場合には安易な投与はやめておきましょう。
(Am J Emerg Med . 2022 Aug;58:39-42.)
なお、diltiazemとmetoprololを併用すると徐脈や低血圧の遷延を引き起こすためやってはいけません。
●amiodarone
amiodaroneはclass IIIの抗
不整脈薬ですが、
AFのrate controlに使用されることもあります。
下記のdigoxin同様にamiodaroneの使用量は減少している傾向にありますが、これは主に副作用に対する懸念によるそうです。死亡率上昇があるかどうかについては議論がありますが、他剤と比較して副作用が多いことは確かです。
症状が強く他のrate control薬剤に耐えられない患者に対して短期間使用するには有効な薬剤ですが、長期的な使用は避けたほうがいいかもしれません。本当に必要になる症例はいるのでしょうけど。
時間経過によりrhythm controlもされることがあるため(本来はこっちがメインの使用方法でしょう)、抗凝固療法をしておいた方がよいです。ただ、除細動をメインの目的にするにはonsetが遅いためイマイチです。
cardioversionありきで投与するのであれば、その前後に(magnesium併用も可)amiodarone投与しておくことは成功率を上昇させる工夫になります。
●digoxin
digoxin使用は減少してきているものの、依然として広く使用されている薬剤です。
適切な腎機能がある場合にはなんといっても使いやすい!
・使いどころは
低血圧+心不全のときが最もよい適応かも・特に、心拍数を低下させると同時に陽性変力作用がある唯一の薬剤
・緊急コン
トロールを要さない軽度~中等度の頻脈にも使っておくことも可能
(作用発現までには数時間かかるため、重症患者が他にたくさんいて一気に対応できないような場合に使っておいてモニタリングのみしておくなんて戦略をとることもあります)
・β遮断薬やCa拮抗薬を使用しても改善に乏しい場合に追加して使用することも可能
でも、ご存知の通り欠点はそれなりにあります。
・onsetが最大6時間と遅すぎる
・cardioversion成功率を低くするかもという報告がある
・心不全の状態にかかわらず心房細動患者への使用と死亡リスク上昇と関連している可能性が指摘されている
でも、やっぱり頼りにしてしまいます。
●magnesium
magnesiumは房室結節の不応期を延長する効果があります。
そのため、AFへの補助治療として期待されています。
実際、
不整脈患者の多くが細胞内Mg不足に陥っているとの報告もあります。
RCTやMAでは、
硫酸マグネシウムはAF with RVRのrate controlやrhythm controlのために他の治療法と併用することでその役割を果たす可能性が示唆されています。
・ERにおいて通常ケア(digoxinが最多使用薬)に加えて、
MgS4~6g追加投与することでrate control可能と報告されたRCTあり
・magnesiumがamiodaroneより洞調律復帰率が高いという報告もある(ちょっと眉唾ですが)
・他の抗
不整脈薬やcardioversionの効果を増強させる
・rhythm controlに失敗しても心拍数低下作用がある
ただし、
単独での使用を支持する説得力のあるエビデンスはまだありません。
rhythm control~電気的除細動か薬物的除細動か?~
electrical cardioversionの方が明らかに利点が多いので、非循環器内科医やあまり薬剤使用に慣れていない場合には電気的除細動を選択するのがいいと思います。
利点➀…成功率が高い
電気的除細動89-96% vs 薬物的除細動50-83%くらいの成功率です。
利点②…(鎮静してしまえば)一瞬で終わる
・4時間以内のER退室率は32% vs 67%、electrical cardioversionで有意に早い
・電気的除細動…180分 vs 薬物的除細動…420分
◦有害事象発症率には有意差なし
利点③…低血圧に対しては安全性が低い
抗不整脈は心臓病に対して使用しづらく、低血圧に対しては安全性が低いと考えられています。
もうこんなときには素直に電気的除細動を選択するのが吉です。
とここまで薬物的除細動よりも電気的除細動を持ち上げてきましたが、実際のところは薬物的除細動も捨てたもんじゃないとは思います。
例えば、
・鎮静しなくていいし、それに伴う合併症も考えなくてよい
・血行動態が安定している場合にはelectrical cardioversionは患者が受け入れにくい
・電気的除細動を行うに足る人員が割けない
というような状況下においては薬物的除細動を選択することもあります。
rhythm controlに積極的なカナダからは、電気的除細動と薬物的除細動を組み合わせた方法(Ottawa Aggressive Protocol)も提案されています。
・procainamide投与後に電気的除細動実施する群と
placebo点滴後に電気的除細動実施する群に分けて比較した、2020年の多施設共同無作為化
プラセボ対照試験
・procainamide投与のみで52%が洞調律復帰
‣さらに電気的除細動により40%が洞調律に移行
‣さらに電気的除細動により77%が洞調律に移行
|
Ottawa Aggressive Protocol
|
|
1)薬物的除細動
・procainamide 1g IV 60分以上かけて投与
◦SBP<100mmHgのときにはやらない
2)電気的除細動
・6時間経口摂取禁止
・propofol IV+fentanyl IVなどによる鎮痛と鎮静を行う
・同期下電気的除細動200Jで実施
・改善がなければパッドを前胸部と背部に装着しなおす
|
特に上で紹介した状況においては、戦略の1つとしてもっておいてもいいかも。
抗凝固療法
脳卒中予防は心房細動を呈する患者を管理する上で重要なステップです。
心房細動がない患者と比較して、
虚血性脳卒中を発症する可能性が4-5倍高いとされているため、脳卒中のリスク評価はERではじめることとし、循環器内科だけにゆだねてはいけません。
2017年にスペインのグループは、ERで処方された抗凝固薬の長期的
転帰を評価するため、62ERで前向き多施設観察
コホート研究を実施しました。
・ER退室時に80.5%が経口抗凝固薬を投与された
・抗凝固薬投与をされた患者は非投与患者に比較して1年後死亡率が低かった
‣これは以前から抗凝固療法を受けていた患者にも当てはまった
救急医は心房細動患者を帰宅させるときには救急外来で抗凝固療法開始することが推奨されます。
リスク層別化を行い、それに準じて抗凝固療法を選択します。
CHA2DS2-VASc scoreが有名であり、男性と女性ではリスク因子としての重みづけが異なることが指摘されています。
2020年度版不整脈薬物治療ガイドライン(日本循環器学会/日本不整脈心電図学会合同ガイドライン)においては、年齢/血管疾患/女性の項目については、日本人の抗凝固療法未施行例における
血栓塞栓症の有意な危険因子ではなかったこと、簡便性などの観点から
CHADS2 scoreを基本とすることが適切と判断されており、こちらの使用を推奨しています。

まとめ

・心房細動は加齢により有病率が上昇し、今後世界的に増加する疾患であると考えられている
・心房細動は構造的な心疾患がなくとも発症する可能性があるが、多くの併存疾患が心筋の構造的な問題を引き起こすことが報告されている
・AF with RVRにおいて、胸痛+STE/STD>2mmがあればAMI合併を疑うこと
◦40歳以上や冠動脈疾患リスクが高い患者にはcTnを測定しておくこと
・発熱+意識障害+AF with RVRでは甲状腺クリーゼの重要な手掛かりとなる
・AF with RVRでは、その発症原因を考えること…"PIRATES"
◦4割弱が急性発症の基礎疾患を有する
|
P – Pulmonary embolism
I – Ischemic heart disease, Inflammation (心筋炎), Idiopathic/iatrogenic
R – Rheumatic heart disease (弁膜症…MR/MS)
A – Alcohol (holiday heart syndrome), Anemia, Atrial enlargement/myxoma, Age
T – Thyroid disorder ( 甲状腺クリーゼ)/Toxins(違法薬物/カフェイン/タバコ/アルコールなど) E – Electrolyte abnormalities, electrocution, exacerbation (of CHF)
S – Sepsis, Stimulants, Sleep apnea |
・血行動態不安定かどうかは"いしき心配"で判断
|
い:息切れ
し:ショックの徴候
き:胸痛
配:肺うっ血
|
・血行動態不安定であれば同期下電気的除細動!標準体重なら100J、肥満では200Jが良いかも。効果なければパッド装着位置をAPにしたり、amiodarone±magnesiumを除細動の前後に入れておくことは有効
・HR>220bpmのAFではWPW症候群を考慮せよ。この場合には房室結節伝導速度を落とすことで副伝導路の優位性が高まりより高度な頻脈になることがあるため注意
・除細動は48時間以内、できれば12時間以内がよい。もしそれを越えて除細動する場合にはヘパリン静注を除細動に先行させよ
・血行動態が安定している場合にはrate controlでもrhythm controlでもよい
・適応は以下
|
rate controlに適する
|
rhythm controlに適する
|
|
・年齢>65歳
・基礎疾患を多数持つ
・発症から48時間以上経過
・persistent AF
・リウマチ性心疾患
・機械弁
|
・年齢≺65歳
・基礎疾患が少ない
・発症から48時間以内
・paroxysmal AF
・3週間以上抗凝固治療がされている
・rate controlへの反応不良
|
・rate contorlの目標はHR100-110bpm
・rate control薬剤の使用方法は概ね以下の通り
◦血行動態安定ならβ遮断薬やCa拮抗薬
※HFrEFがある場合には禁忌!
◦不安定性が強いときにはdigoxinを選択
◦血行動態不安定で、特に除細動を考慮している場合にはamiodarone
◦血行動態不安定で、除細動を考慮していない場合にはlandiolol少量から
◦Mgは上記治療に組み合わせてみてもいいかも
|
薬剤
|
投与方法
|
禁忌
|
|
metoprolol
|
5分かけて2.5-5mg IV 5分毎 max15mg
|
|
|
landiolol
|
(心機能低下時)
1mcg/kg/minから開始し、10分毎に1-2mcg/kg/minずつ増量
max 10mcg/kg/min
|
喘息に注意
|
|
diltiazem
|
・5分かけて0.25mg/kg(max 20mg) IV
→5-15mg/hrで持続投与
・初回投与に反応が乏しければ、15分後に0.35mg/kg(max 25mg)IVも可能
|
|
|
verapamil
|
5分かけて5-10mg IV
|
|
|
digoxin
|
5分かけて0.25-0.5mg IV 6時間毎(24時間で最大1.5mgまで)
|
腎不全
|
|
amiodarone
|
125mg+5%ブドウ糖液100ml 600ml/hrで投与
→750mg+5%ブドウ糖液500mlを33ml/hrで6時間
→17ml/hrで18時間
|
|
|
magnesium
|
30分かけてMgS 2.5-4.5g+生食100ml IV
※硫酸Mg20mEq/20mlには2.46gのMgSが含まれる
|
腎不全では注意
|
・安定している場合の除細動方法は電気的>薬物的除細動で利点が多い。特に低血圧の場合には薬剤は使用しづらい
・でも、薬物的除細動を考慮したいときもある
|
薬剤
|
投与量
|
効果発現
|
注意
|
副作用
|
|
Procainamide
|
・2-10mg/kg IV 10分以上かけて
・1000mg IV 60分以上かけて
|
1時間で58.3%
|
・心疾患があっても使用可能
(慎重投与)
|
・低血圧5-8%
・徐脈
|
|
Flecainide
|
1-2mg/kg(max150mg) IV 10分以上かけて
|
8時間以内に51-72%
(多くは3-5時間)
|
・bioavailability良好(>90%)
・血圧には影響なし
|
・頭痛
・めまい
・振戦
|
|
Amiodarone
|
125mg+5%ブドウ糖液100ml 600ml/hrで投与
→750mg+5%ブドウ糖液500mlを33ml/hrで6時間
→17ml/hrで18時間
|
・急性期には効かない
・rate controlとしては使用可
|
・心疾患があってもOK
|
・静脈炎
・低血圧
|
・救急医は心房細動患者を帰宅させるときには、CHADS2 scoreでリスク層別化を行い、救急外来で抗凝固療法開始すること











